
Funktionelle Magnetresonanztomographie
Seit Anfang der 90iger Jahre steht neben den etablierten Verfahren (PET, SPECT, MEG, EEG) eine neue Methode zur Messung funktioneller Parameter des Kortex zur Verfügung. Mittels funktioneller Kernspintomographie ist es möglich, kortikale Reaktionen auf externe Reize mit einer den bisherigen Verfahren überlegenen räumlichen Auflösung zu messen. Weiterhin lassen sich die erkannten aktivierten Areale leicht den entsprechenden anatomischen Strukturen zuordnen. Während die ersten Ergebnisse noch mit Hilfe von exogenen Kontrastmitteln erzielt wurden [4], können funktionelle Untersuchungen mittlerweile auch ohne deren Applikation durchgeführt werden. Bei diesen Messungen ist die lokale Oxygenierung des Blutes der entscheidende, die Signalintensität beeinflussende Parameter.
Dieses als BOLD-Effekt bekannte Phänomen wurde 1990 von Ogawa et al. [7,8] beschrieben. Dabei macht man sich die unterschiedlichen magnetischen Eigen-schaften von oxygenierten und desoxygenierten Blut zu nutze. Verantwortlich dafür ist das an Hämoglobin gebundene Eisen. Dieses wird für den Sauerstofftransport oxygeniert und es entsteht Oxyhämoglobin, ein Molekül, in welchem die magnetische Eigenschaft des Eisens weitgehend maskiert ist. Es ist deshalb diamagnetisch. Im Gegensatz dazu steht das Desoxyhämoglobin, dessen Eisenatome ihre volle magnetische Eigenschaft besitzen und somit paramagnetisch sind. Das paramagnetische Desoxyhämoglobin verursacht in seinem unmittelbaren Umfeld Magnetfeldinhomogenitäten und induziert in der Umgebung der Gefäße einen lokalen Magnetfeld-gradienten.
Bei der Stimulation von Kortexarealen kommt es zu einer Steigerung der kortikalen Metabolismusrate (CMRO2) und das aktivierte Areal reagiert mit einem erhöhten regionalen cerebralen Blutfluss (rCBF). Dabei wird mehr Sauerstoff antransportiert als durch die neuronale Aktivität verbraucht werden kann. Auf Grund dessen steigt im venösen Schenkel des Kapillarbettes der Sauerstoffgehalt, und das Verhältnis von Oxyhämoglobin zu Desoxyhämoglobin verschiebt sich zu Gunsten des Oxyhämoglobins. Durch Abnahme des Anteils des paramagnetischen desoxygenierten Blutes, verringern sich auch die in der Umgebung auftretenden Magnetfeldinhomogenitäten. Dies bedeutet eine langsamere Dephasierung der Protonenspins in der angeregten Schicht, was zu einem Signalanstieg im T2* gewichteten Gradientenbild in der aktiven Hirnregion führt, welcher je nach Feldstärke bis zu 15% betragen kann (Abb. 29).
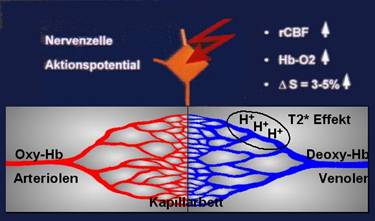
Abb.
29 : BOLD-Effekt
Die BOLD-Antwort auf einen Stimulus weist einen charakteristischen zeitlichen Verlauf auf, der unbedingt bei der Messplanung berücksichtigt werden sollte. Der BOLD-Effekt basiert wie erwähnt auf dem O2-Gehalt des Blutes – einem indirekten Indikator für den CMRO2 und somit für die kortikale Aktivität. Da die Aktivierung von Hirnarealen mit einer Depolarisierung des Membranpotenzials der Neuronen einher geht, dessen Erhaltung Energie und Sauerstoff benötigt, kommt es in diesen Regionen zu einer Steigerung des Blutflusses. Während der Metabolismus sofort einsetzt, benötigt die O2 –Versorgung eine Latenzzeit von 1-2 Sekunden, was die Ursache für diesen „initial dip“ ist. Die eigentliche BOLD-Antwort erreicht ihren Maximalwert erst mit einer Verzögerung von 4-6 Sekunden und wird danach von einem bis zu 30 Sekunden dauernden Undershoot gefolgt (Abb. 33).
Abb. 30: Zeitlicher Verlauf der BOLD-Antwort
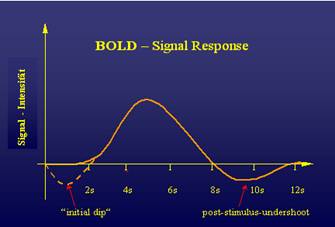
Bei der fMRI-Messung muss darauf geachtet werden, dass die Stimuluspräsentation und Antwortdetektion dem zeitlichen Verlauf der BOLD-Antwort folgen und die Wiederholungsfrequenz so gewählt wird, dass eine Beeinflussung der Aktivierung durch den Post-Stimulus-Undershoot der vorhergehenden Aktivierung ausgeschlossen werden kann. In den aktiven Hirnregionen kommt es zusätzlich noch zum sogenannten "lnflow-Effekt". Dieser besteht darin, dass für den erhöhten Sauerstoffantransport die präkapillaren Sphinkteren dilatieren, der Blutfluss in das Kapillarbett ansteigt und somit nicht gesättigte Spins aus den benachbarten Schichten einströmen, was zu einem zusätzlichen Signalanstieg in der aktiven Region führt [6]. Inflow-Effekte können sich mit eigentlichen Aktivierungen überlagern und das Ergebnis der Messung verfälschen.
Während einer fMRI-Messung wechseln sich Perioden, in denen durch geeignete Paradigmen wie beispielsweise Finger-zu-Daumen-Tippen (FDT) die entsprechenden Hirnareale aktiviert werden, mit Perioden einer Ruhephase ab. Die Signaldifferenzen der beiden Messperioden in den einzelnen Pixels der Bildmatrix können zu einer Aktivierungskarte des Kortex weiterverarbeite werden (Abb. 31).
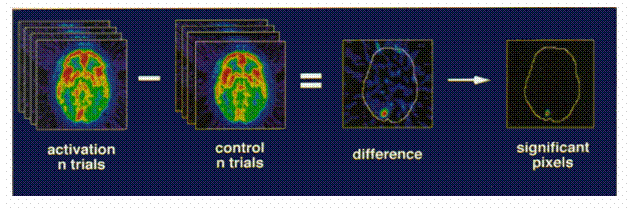
Abb. 31: Aktivierungskarte des Kortex und Isolierung der signifikanten Aktivierungen (am Beispiel von PET-Bildern)
Bei einer Feldstärke von 1.5 Tesla bewegen sich diese Signaldifferenzen in der Größenordnung von 3-5%. Zur Darstellung dieser feinen Signalunterschiede eignen sich statistische Auswertungsverfahren, die auf einer Differenzbildung zwischen den Ruhe- und Aktivierungsbildern [3,9] beruhen (Z-Score, Student t-test) oder die mit dem Intensitäts-Zeit-Verlauf mit einer geeigneten Referenzfunktion (z.B. Rechteckfunktion oder Sinusfunktion) korrelieren [2]. Die Unterteilung des Paradigmas in sich abwechselnde Ruhe und Aktivitätsphasen (Abb. 33) ermöglicht es, Störungen, die meist nicht diese Periodizität aufweisen, zu eliminieren (Abb. 32).
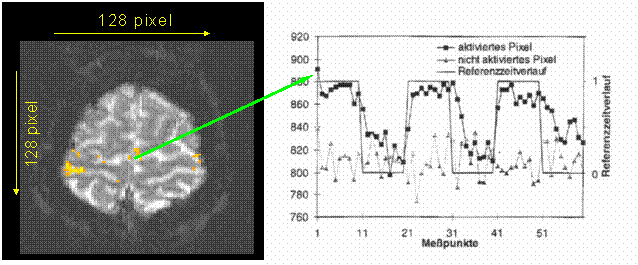
Abb. 32: Signalzeitverlauf aktivierter Pixels und nicht aktivierter Pixels mit
Referenzzeitverlauf - Die Kurve des nicht aktivierten Pixels weist nicht
die Periodizität des Referenzzeitverlaufes auf, weshalb sie nicht bei der
Signalaufbereitung berücksichtigt werden, die Kurve der aktivierten Pixels
entspricht der Periodizität und wird berücksichtigt. Auf diese Weise ist es möglich Aktivierungen/Störungen die nicht
dem Paradigma entsprechen als das
Ergebnis beeinflussende Größe
auszuschließen
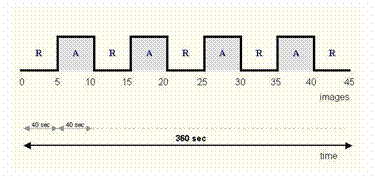
Abb. 33 : Beispiel für ein einfaches Block-Design Paradigma mit 4 Aktivitäts-
und 5 Ruhe-Phasen. Jede Phase dauert 40 sec, die gesamte Messung 360 sec.
In dieser Zeit werden 45 Ganzhirnscanns
aufgenommen.
Aber auch wesentlich kompliziertere mathematische Verfahren wie Fast-Fourier-Transformation, Faktorenanalyse [1] oder neuronale Netze [5] kommen zur Anwendung. Die beim funktionellen MRI gemessenen Effekte sind relativ klein und von Artefakten überlagert, so dass 40-200 Wiederholungen nötig sind, um eine Antwort statistisch signifikant detektieren zu können. Um für komplexe kognitive Stimulationsexperimente die Empfindlichkeit zu steigern und damit die Untersuchungszeit in vertretbarem Rahmen zu halten, ist eine Verbesserung des Signal-Artefakt-Verhältnisses wünschenswert. Als Quelle von Artefakten lassen sich neben regionalen Signalverlusten in der Nähe der Schädelhöhlen, Geisterbildern (ghosts), Flussartefakten in der Nähe großer Gefäße sowie mangelnder Langzeitstabilität des MR-Scanners insbesondere Körperbewegungen des Probanden während der Messung und kurz dauernde physiologische Bewegungen (Pulsationen, Schlucken) ausmachen. Aus diesem Grund wird vor der Auswertung der Daten noch eine Bewegungskorrektur derjenigen Bilder durchgeführt, die sich gegenüber einem Referenzbild, z.B. dem ersten Bild der Messserie, aus ihrer ursprünglichen Position bewegt haben. Durch Rücktranslation und Rückrotation werden alle Bilder der Messserie mit dem Referenzbild wieder zur Deckung gebracht [11] (Abb. 34).
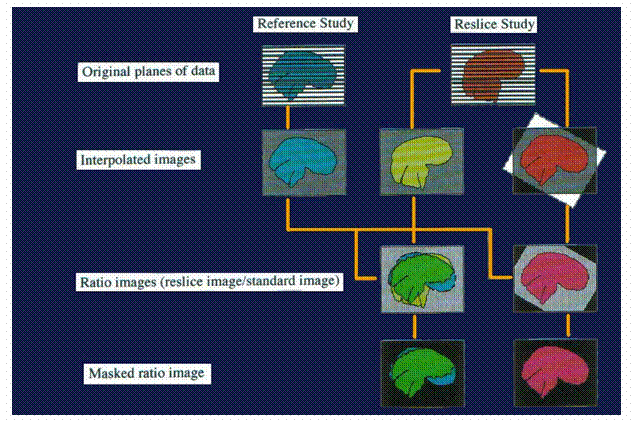
Abb.
40 : Bewegungskorrektur
Das blaue Bild in der ersten Reihe in Abb.
34 ist das sogenannte Referenzbild, das orange, das zu registrierende bzw. reclise-Bild. Das orange Bild soll nun so gut wie möglich
mit dem Referenzbild zur Deckung gebracht werden. Tomographische
Daten habe häufig nicht kubische Voxel so das die beiden Datensätze zu
kubischen Voxel interpoliert werden müssen bevor die „Rigid-Body“
Rotation durchgeführt werden kann (2.Reihe), das gelbe Gehirn zeigt das orange
Gehirn nach Interpolation jedoch ohne „Rigid-Body“
Rotation oder Translation. Das rote Gehirn der
2.Reihe zeigt das orange Bild der 1.Reihe nach Interpolationund
nach „Rigid- Body“ Rotation und Translation
zu der Position, welche für die Registrierung mit dem Referenzbild (blaues Bild
1.Reihe) notwendig ist. Der automatische Registrierungsalgorithmus versucht nun
das orange Bild möglichst exakt auf das blaue Bild hin zu orientieren indem das
Verhältnis der Voxelintensität des zu reorientierenden Bildes zum Referenzbild auf einer Voxelbasis berechnet wird und die Varianz dieses Verhältnisses
minimiert wird. Das wird schematisch in der 3.Reihe gezeigt. Im Referenzbild
werden alle Areale außerhalb des Gehirns maskiert. Das resultierende maskierte
Verhältnisbild (4.Reihe) hat sehr heterogene Werte wenn die beiden Bilder nur
sehr schlecht registriert sind (grünes Bild) und sehr homogene Werte wenn die
Bilder gut registriert sind (rotes Bild). Die Heterogenität des maskierten
Verhältnisbildes kann quantifiziert werden durch Berechnung der
Standardabweichung aller Voxelwerte über alle
nichtmaskierten Voxel. Diese Standardabweichung wird durch Anpassung der
Parameter der „Rigid-Body“ Transformation minimiert.
Der Algorithmus geht davon aus, dass die Bilder dann zur Deckung gebracht
werden, wenn die Standardabweichung ein Minimum hat.
Durch intelligente Kombination der Untersuchungsparameter lässt sich eine weitere Verbesserung des Signal-Artefakt-Verhältnisses erzielen. Um ein stärkeres Signal zu erhalten, kann man das Volumen, aus dem das Signal kommt z.B. durch Zunahme der Schichtdicke vergrößern, da die Signalintensität proportional mit der Volumenzunahme ansteigt. Das Grundrauschen, welches stochastisch (d.h. nach statistischen Gesetzen fluktuierend) und ubiquitär auftritt, nimmt dagegen nur mit der Quadratwurzel des Volumens zu. Analoges gilt für eine Verlängerung der Messzeit. Eine Messzeitverlängerung wirft aber Probleme mit der Langzeitstabilität des Scanners und der Patientenlagerung auf, eine Volumenzunahme geht auf Kosten der Auflösung. Eine Erhöhung der Auflösung durch Vergrößerung der Matrix von z.B. 256 x 256 auf 512 x 512 bei halbierter Schichtdicke muss mit einer 64fachen Messzeit erkauft werden, wenn kein Kontrast geopfert werden soll. Wie anhand dieser Beispiele zu sehen ist, fordert der effektive und ökonomische Einsatz des (f)MRI vom Untersucher umfangreiche und fundierte Kenntnisse der einschlägigen MR-Physik, da die zur Untersuchung einzustellenden Parameter sich gegenseitig mannigfaltig beeinflussen und somit auch großen Einfluss auf die Qualität des Untersuchungsergebnisses haben.
Um die aktivierten Hirnareale auch anatomisch zuordnen zu können, wird dem funktionellen MR-Bild ein anatomisches Bild untergelegt. Dem Gehirn kann aber auch ein spezielles Koordinatensystem zugrunde gelegt werden, wodurch die anatomische Auswertung dann erheblich erleichtert wird. Für funktionelle Gehirnuntersuchungen eignet sich dazu vor allem das Standartgehirn nach Talairach [10] (Abb. 35).
Abb. 35: ein in das Talairach-Koordinatensystem
übertragenes Gehirn
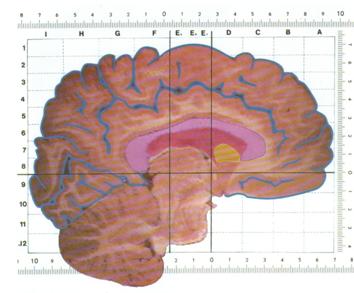

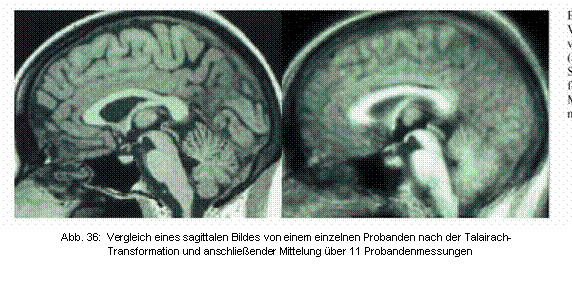
Es beruht auf einer transversalen Grundebene durch die vordere und hintere Kommissur, auf einer koronaren Grundebene vertikal dazu durch die vordere Kommissur und auf einer sagittalen Grundebene durch den Interhemisphärenspalt und stellt somit ein universelles Koordinatensystem dar, in dem gleiche morphologische Strukturen unterschiedlicher Gehirne immer an den selben Koordinaten lokalisiert sind. Diese Transformation auf ein Standartgehirn ermöglicht auch die statistische Analyse der Ergebnisse mehrerer Gehirne für Gruppenvergleiche. Diese Mittelung verschiedener Gehirne geht natürlich mit einem Verlust an Trennschärfe einher, der in Abbildung 36 dargestellt ist und die Zuordnung gefundener Aktivierungen zu kleinen anatomische Strukturen erschwert oder unmöglich machen kann.
Die funktionelle Magnetresonanztomographie (fMRI) zeichnet sich gegenüber funktionellen Gehirnuntersuchungen mit der Positronen-Emmissions-Tomographie (PET) oder der Single-Photon-Emmissions-Computer-Tomographie (SPECT) durch Nicht-invasivität und fehlende Strahlenbelastung sowie durch eine wesentlich bessere räumliche (Millimeterbereich) und zeitliche Auflösung (Sekundenbereich) aus.
Durch das fMRI konnten nicht nur Ergebnisse anderer Modalitäten bestätigt, sondern auch neue und wesentliche Erkenntnisse gewonnen werden. Bei allen Erfolgen des fMRI darf aber nicht vergessen werden, dass die ermittelte Messgröße nur einen indirekten Einblick in die Funktion des Gehirns gibt. Außerdem ist diese Methode von den Größen cerebraler Blutfluss (CBF), cerebrales Blutvolumen (CBV) und cerebrale metabolische Umsatzrate (CMRO2) sowie der Mitarbeit der Untersuchten abhängig, was sie klinisch nur bedingt einsetzbar macht. Neben der Anwendung in der Forschung zur Funktionsweise des Gehirns zeichnet sich vor allem die Bereiche Neurochirurgie, Neurologie und Psychatrie als bedeutungsvolles Einsatzgebiet des fMRI ab. Mit der rapide fortschreitenden technischen und methodischen Entwicklung und Verfeinerung der Magnetresonanztomographie sind weitere klinische Anwendungen der FMRT in der neuroradiologischen Diagnostik zu erwarten.